Atom Kimia
Pengenalan Atom dan Isotop
A. Dasar Pengertian
Atom dapat diartikan sebagai bahan dasar pembentuk semua materi yang ada didunia ini. Baik materi itu padat, cair, ataupun gas, materi tersebut akan terbuat dari atom.
 |
| Atom dalam berbagai wujud zat |
Atom berukuran sangat kecil, meskipun begitu, didalam atom masih terdapat bagian-bagian kecil lainnya yang menyusun sebuah atom. Bagian atom yang menyusun atom adalah inti atom/nukleus (proton dan neutron) dan elektron yang berputar mengelilingi inti atom. Berikut adalah gambaran atom sederhana yang dibuat oleh Niels Bohr untuk menjelaskan bagian atom.
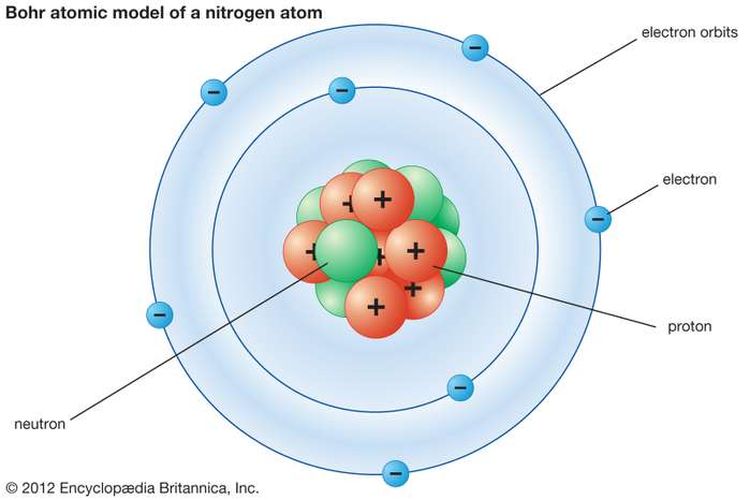 |
| Model Atom Niels Bohr |
Nampak dalam atom niels bohr, menunjukan bahwa inti atom terdiri dari nukleus yang berdekatan dengan proton, dan mereka dikelilingi oleh elektron. Memang nampak elektron bergerak dalam suatu lingkaran yang tetap. Namun sebenarnya, elektron ini mengelilingi inti dengan segala arah dengan daerah probabilitas lintasannya yang disebut sebagai awan elektron. Model awan atom ini digambarkan oleh ilmuwan fisika modern seperti, Erwin Schrödinger, Louis Victor de Broglie, dan Werner Heinsberg. Model yang dibuat mereka ini disebut sebagai model atom mekanika kuantum. Mengenai teori ini akan dibahas lebih lanjut di materi dualisme gelombang (Fisika).
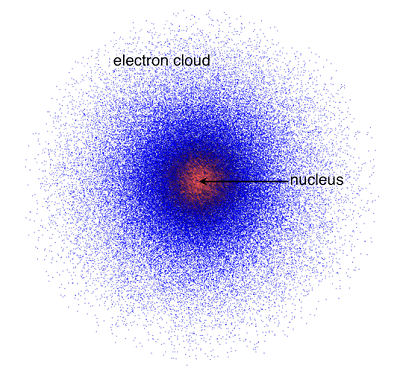 |
| Atom Mekanika Kuantum |
Elektron dalam atom akan berputar mengelilingi inti atom dengan cepat, sedangkan nukleus akan tetap diam pada tempatnya. Alasan elektron berputar cepat adalah agar elektron tidak jatuh kedalam nukleus. Namun, elektron tetap tidak akan keluar atom karena masih mendapat gaya tarik dari proton. Sehingga elektron akan tetap berada dijalurnya/kulitnya. Sedangkan, proton dapat tetap stabil dalam inti dikarenakan adanya neutron yang bermuatan netral yang menjaga proton tetap berdekatan dan tidak berhamburan.
Mengesampingkan muatan listriknya, proton dan neutron memiliki massa dan ukuran yang kurang lebih sama. Berikut adalah massa dari proton, neutron, dan elektron:
1. Proton: 1,673 x 10 ̄²⁴ gram = 1,0075 sma ≈ 1 sma
2. Neutron: 1,678 x 10 ̄²⁴ gram = 1,0087 sma ≈ 1 sma
3. Elektron: 9,109 x 10 ̄²⁸ gram = 0,00054858 sma ≈ 0 sma
Sma adalah singkatan dari satuan massa atom.1 sma ekuivalen dengan massa unsur teringan dalam tabel periodik, yakni hidrogen yang hanya memiliki 1 proton dan 1 elektron.
B. Notasi Atom
- Kalsium yang memiliki 20 elektron, 20 proton, dan 20 neutron, maka notasi atomnya adalah ₂₀Ca⁴⁰
- Oksigen yang memiliki 8 elektron, 8 proton, dan 8 neutron, maka notasi atomnya adalah ₈O¹⁶
- Karbon yang memiliki 6 elektron, 6 proton, dan 7 neutron, maka notasi atomnya adalah ₆C¹³
C. Net Charge
- Suatu atom dengan 3 elektron, 3 neutron, dan 3 proton, maka muatannya adalah 3-3= 0 (netral)
- Suatu atom dengan 3 elektron, 3 neutron, dan 4 proton, maka muatannya adalah 4-3= +1 (ion)
- Suatu atom dengan 4 elektron, 3 neutron, dan 3 proton, maka muatannya adalah 3-4= -1 (ion)
D. Isotop
- Karbon
- Karbon-12: proton= 6, neutron= 6, notasi atom: ₆C¹²
- Karbon-13: proton= 6, neutron= 7, notasi atom: ₆C¹³
- Karbon-14: proton= 6, neutron= 8, notasi atom: ₆C¹⁴
- Besi
- Besi-54: proton= 26, neutron= 28, notasi atom: ₂₆Fe⁵⁴
- Besi-56: proton= 26, neutron= 30, notasi atom: ₂₆Fe⁵⁶
- Besi-57: proton= 26, neutron= 31, notasi atom: ₂₆Fe⁵⁷
- Besi-58: proton= 26, neutron= 32, notasi atom: ₂₆Fe⁵⁸

Komentar
Posting Komentar