Teori Atom
Teori Model Atom Lengkap dan Sejarah Penemuannya
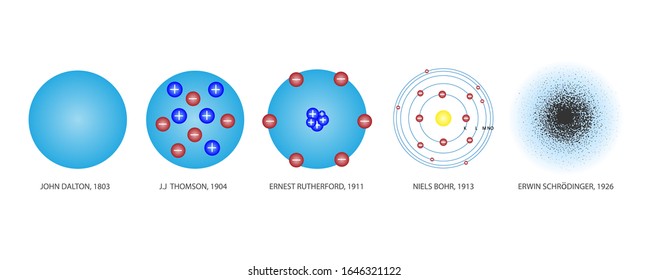 |
| Sejarah Perkembangan Model Atom |
Dalam perkembangannya, konsep akan ilmu pengetahuan alam yang diketahui oleh manusia semakin meluas dan semakin cepat untuk menemukan hal-hal baru. Hal ini dikarenakan adanya penemuan teknologi ataupun ilmuwan yang pemikirannya semakin berkembang akibat penemuan-penemuan masa lampau. Salah satu hal yang diamati oleh banyak ilmuwan ini adalah atom. Sebagaimana kita tahu, bahwa atom adalah suatu bahan yang menyusun segala materi baik organik maupun anorganik yang ada di dunia yang kita tahu. Maka dari itu, para ilmuwan tertarik untuk menyelidiki bagaimana bentuk, struktur, dan karakteristik dari atom ini. Berikut adalah perkembangan teori atom dari masa ke masa:
1. Leuikippos dan Demokritos (450-470 SM)
Demokritos Model Atom Demokrtios
Leuikippos dan Demokritos memiliki hubungan guru dan murid. Mereka berdua adalah seorang filsafat barat pra-Sokrates dari peradaban Yunani Kuno. Awalnya Leuikippos dan Demokritos memiliki pandangan bahwa ada suatu materi yang sangat kecil yang menyusun materi lainnya yang lebih besar. Mereka memperhatikan bagaimana sebuah benda dapat dipotong ataupun dibagi menjadi lebih kecil. Bagaimana jika benda tersebut dipotong hingga sangat kecil hingga tidak dapat terlihat mata dan tidak dapat dibagi lagi? Maka dari itu, Demokritos membuat istilah yang ia sebut atomos atau yang artinya tidak dapat dibagi lagi. Menurut Leuikippos, atom adalah elemen yang tak terbatas dan abadi, terus bergerak, dan memiliki jumlah yang tak terbatas. Adapun, karakteristik atom Leuikippos dan Demokritos adalah:
- Terdapat partikel mikroskopis (Atom) yang menyusun segala sesuatu materi di dunia
- Partikel mikroskopis tersebut tidak dapat dimusnahkan, diciptakan, dan dipisahkan
- Terdapat ruang kosong diantara partikel mikroskopis dengan partikel mikroskopis lainnya.
- Partikel tersebut bergerak secara konstan.
2. John Dalton (1803)
John Dalton, seorang ilmuwan asal Inggris, mencetuskan teori atom terbaru seiring perkembangan dunia kimia, dimana telah ditemukannya hukum kekekalan massa oleh Antoine Lavoisier ditahun 1789 yang menyatakan bahwa total massa produk dalam suatu reaksi akan sama dengan massa rekatan, dan hukum susunan tetap oleh Joseph Louis Proust ditahun 1797 yang menyatakan bahwa suatu senyawa kimia terdiri dari unsur dengan perbandingan yang sama.
Menurut Dalton, atom memiliki karakteristik sebagai berikut:
- Atom merupakan materi terkecil di dunia dan berbentuk seperti bola pejal yang tidak dapat dibagi lagi (tidak ada materi sub-atomik).
- Atom dalam satu unsur memiliki struktur dan karakteristik yang sama, tapi akan berbeda jika unsurnya pun berbeda.
- Secara kimia antar atom dapat membentuk molekul dengan perbandingan bulat sederhana. Perbandingan ini disebut sebagai hukum perbandingan berganda atau hukum Dalton.
- Tidak dapat menjelaskan bagaimana atom dapat bersenyawa dengan atom lain
- Tidak dapat menjelaskan bagaimana senyawa terdiri dari ion-ion
- Tidak dapat menjelaskan bagaimana suatu larutan dapat menghantar listrik.
Terlepas dari beberapa kekurangan, John Dalton merupakan pelopor pengembangan teori atom di dunia modern, setelah hampir 2000 tahun sejak teori atom yang dikemukakan Demokritos.
3. J.J Thomson (1897)
Joseph John Thomson merupakan seorang ilmuwan fisika Amerika Serikat yang dikenal akan teori atomnya yang menjelaskan bahwa atom memiliki bagian sub-atomik lagi yang disebut sebagai elektron. J.J Thomson menemukan elektron dengan memperhatikan percobaan tabung sinar katode yang telah dilakukan oleh beberapa ilmuwan sebelumnya. Pada prinsipnya, tabung sinar katode ini merupakan tabung kaca hampa udara dengan logam sebagai elektroda dikedua ujungnya. Logam tersebut akan dihubungkan dengan tegangan listrik yang tinggi, dimana kutub negatif adalah katoda dan kutub positif adalah anoda. Setelah dinyalakan, dari katoda akan muncul seberkas sinar menuju anoda. Sinar tersebut dikenal dengan sinar katoda.
Seorang ilmuwan sebelum J.J Thomson yakni Arthur Schuster telah memodifikasi percobaan ini dengan menambahkan plat kutub negatif dan positif secara paralel terhadap sinar katoda dan memberikan potensial listrik. Akibat potensial listrik yang menyebabkan adanya medan listrik, membelokan sinar katoda ke arah plat positif. Sehingga dapat dikatakan bahwa sinar katoda ini bermuatan negatif. Lebih jauh lagi, Arthur Schuster mengukur pembelokan sinar katoda sesuai dengan potensial listrik yang diberikan, dan mampu memperkirakan rasio massa terhadap muatan (m/Q dengan satuan kg/C). Namun, klaim Arthur Schuster ini mendapat pertentangan karena perhitungannya yang terlalu besar daripada yang diperkirakan. Hal ini dikarenakan asumsi Arthur Schuster yang menyebut sinar katoda adalah sebuah partikel pembawa muatan (negatif) yang merupakan sebuah atom hidrogen.
 |
| Tabung sinar katode |
Pada tahun 1897, J.J Thomson kembali memodifikasi percobaan tabung sinar katode dengan menambahkan dua magnet yang berbeda kutubnya pada kedua sisi tabung. Hal ini juga membelokan sinar katoda. Hal ini membantu Thomson untuk menghitung rasio massa terhadap muatan yang lebih akurat daripada Arthur Schuster. Thomson kemudian mengulangi percobaan ini dengan jenis katoda yang berbeda. Namun, hasil yang didapatkan tetap konstan. Thomson meyakini bahwa sinar katoda yang dihasilkan pada percobaan tabung sinar katoda merupakan sebuah partikel baru yang memiliki karakteristik khusus dan bukannya sebuah gelombang, atom, unsur, ataupun molekul seperti yang diyakni sebelumnya. Sinar ini jauh lebih ringan dari atom hidrogen. Thomson kemudian membuat kesimpulan yakni:
- Sinar katoda bermuatan negatif
- Partikel sinar katoda berasal dari dalam atom katoda karena memiliki massa sekitar 1/2000 dari massa atom unsur teringan (hidrogen)
- Partikel sinar katoda merupakan partikel sub-atomik yang dapat ditemukan disemua unsur
Pada akhirnya, Thomson menyebut partikel sinar katoda ini sebagai elektron.
Sejak penemuan elektron ini, Thomson membuat sebuah model atom baru. Elektron memiliki muatan negatif, sedangkan atom itu sendiri adalah netral. Kemudian, Thomson menggagas bahwa atom memiliki muatan positif pula untuk mengimbangi elektron. Thomson menggambarkan bahwa atom memiliki elektron yang tersebar merata pada bola atom yang bermuatan positif. Penggambaran atom Thomson ini mirip dengan sebuah hidangan roti kismis. Maka dari itu, model atom Thomson juga sering disebut sebagai model atom roti kismis.
Meskipun J.J Thomson telah berjasa pada dunia sains dengan penemuannya akan elektron, masih ada beberapa kekurangan dalam model atomnya yakni tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom. Selain kekurangan tersebut, model atom Thomson belum banyak diterima oleh banyak ilmuwan. Hantaro Nagaoka adalah salah satu diantara mereka, dimana ia menolak model atom Thomson dengan alasan muatan yang berbeda tidak dapat menembus satu sama lain.
3. Ernest Rutherford (1911)
Ernest Rutherford merupakan seorang fisikawan dari Selandia Baru. Beliau pernah menjadi kolega dari J.J Thomson di Universitas Cambridge. Mereka sudah bekerja sama sejak penelitian sinar katoda yang akhirnya J.J Thomson menemukan elektron di tahun 1897.
Dalam sejarah perkembangan atom, Ernest Rutherford dikenal karena menemukan nukleus/inti dalam atom dalam percobaan lempeng emas Rutherford atau percobaan Geiger-Marsden. Rutherford bersama Hans Geiger dan Ernest Meiden melakukan percobaan dengan menembakan seberkas sinar alpha (α) pada lembaran tipis emas murni. Sinar alpha yang digunakan dalam percobaan ini merupakan hasil dari peluruhan radium. Dimana radium ini disimpan dalam kotak terbuat dari timah yang dilubangi bagian depannya untuk seberkas sinar dapat memancar keluar. Sedangkan lempeng emas tipis itu dikelilingi oleh layar detektor yang dapat mengkilap ketika terkena sinar alpha.
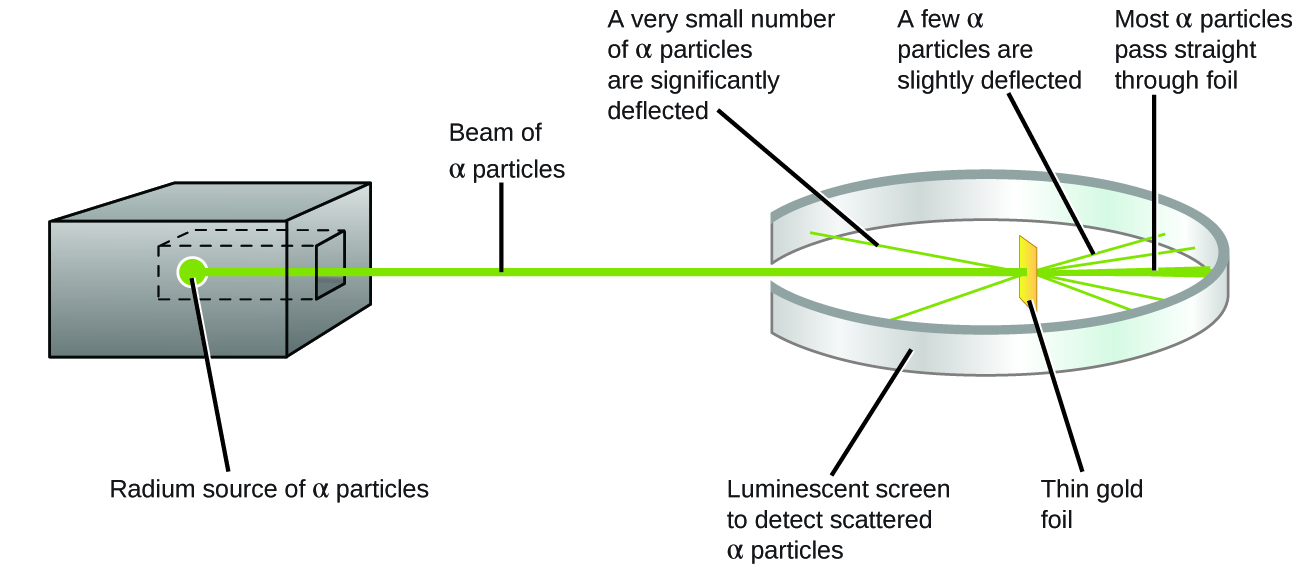 |
| Diagram Percobaan Lempeng Emas Rutherford |
 |
| Alat Percobaan yang dirancang Rutherdord, Geiger, dan Marsden |
Jika model atom Rutherford benar, maka sinar alpha akan langsung menembus lempeng tipis emasnya. Namun, pada hasil percobaannya hanya sebagian sinar alpha yang menembus langsung lempeng tipis emas, adapula yang dibelokan, dan bahkan memantul.
.
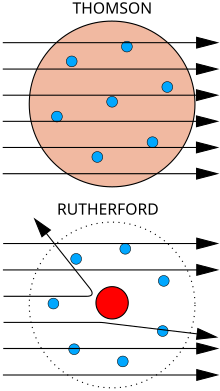 |
| (Atas) Jika teori model atom Thomson benar, (Bawah) Hasil percobaan lempeng emas Rutherford |
Alasan Rutherford memilih emas dalam percobaannya adalah sifat emas yang dapat dengan mudah dibentuk. Karena jika lempengan terlalu tebal, akan mustahil sinar alpha dapat menembusnya. Berdasarkan percobaannya, Rutherford mengambil kesimpulan bahwa:
- Atom memiliki sebuah inti yang bermuatan positif dan terdapat elektron yang mengelilingi inti
- Sebagian besar atom terdiri dari ruang kosong (karena ada sinar alpha yang dipantulkan dan dibelokan oleh lempeng emas)
Namun, tetap saja model atom Rutherford menimbulkan pertanyaan dikalangan ilmuwan, seperti bagaimana elektron tetap dapat berada dilintasannya dan tidak jatuh ke dalam inti atom, sesuai dengan konsep fisika mekanik, dimana apabila medan bermuatan negatif bergerak di inti yang positif akan memancarkan energi, hingga pada akhirnya energi elektron itu kehabisan energi dan jatuh. Karena jika demikian, hal ini menunjukan bahwa semua unsur atom tidaklah stabil. Persoalan ini akan dijawab oleh ilmuwan berikutnya yakni Niels Bohr.
4. Niels Bohr (1913)
 |
| Niels Bohr |
 |
| Model Atom Bohr |
Kemudian untuk merumuskan pemikirannya, Bohr membuat beberapa postulat yakni:
- Elektron-elektron bergerak di dalam orbit-orbit/kulitnya (orbit stasioner) dan memiliki momenta yang terkuantisasi, dan energi yang terkuantisasi. Sehingga hanya beberapa orbit spesifik yang dimungkinkan ada yang berada pada jarak yang spesifik dari inti
- Elektron-elektron tidak akan kehilangan energi ketika bergerak di dalam orbit, melainkan akan tetap stabil di dalam sebuah orbit yang tidak meluruh.
- Jika elektron berpindah dari tingkat energi rendah ke tingkat energi lebih tinggi, maka elektron menyerap energi. Peristiwa ini disebut eksitasi
- Jika elektron berpindah dari tingkat energi tinggi ke tinggkat energi lebih rendah, maka elektron memancarkan energi. Peristiwa ini disebut deeksitasi
- Energi yang diserap/dipancarkan ketika perpindahan orbit elektron akan terlihat sebagai spektrum atom.
Meski telah dijelaskan secara kompleks dengan menggunakan sudut pandang baru, atom Bohr masih memiliki kekurangan, yakni tidak dapat menjelaskan spektrum atom dari unsur atom yang memiliki elektron banyak, model atom Bohr hanya dapat menjelaskan atom yang memiliki 1 elektron. Lebih lanjut lagi, model Bohr juga tidak dapat menjelaskan mengapa hanya beberapa garis spektrum atom yang terlihat lebih jelas ataupun mengapa garis spektrum atom dapat terpecah menjadi 3 garis karena adanya medan magnet (Efek Zeeman).
5. Teori Mekanika Kuantum (1920)
Teori model atom mekanika kuantum adalah teori model atom yang paling terbaru sampai saat ini. Sama seperti Niels Bohr, model ini juga menggunakan konsep mekanika kuantum untuk menjelaskan karakteristik atom yang tidak bisa dijelaskan hanya dengan fisika mekanik. Teori mekanika kuantum ini terbentuk dari gagasan beberapa ilmuwan, seperti Erwin Schrödinger, Werner Heisenberg, Louis de Broglie, James Chadwick, dan masih banyak lagi. Namun, secara umum Erwin Schrödinger, seorang ilmuwan fisika dari Austria yang menjadi tokoh penting di mekanika kuantum ini. Teori ini menyatakan bahwa:
- Elektron atom memiliki sifat partikel dan sifat gelombang (dualisme partikel gelombang)
- Orbital atom/awan elektron didefinisikan sebagai wilayah kemungkinan terbesar ditemukannya elektron → terdapat 4 orbital yakni s,p,d,f.
- Adanya asas ketidakpastian Heisenberg, yakni kita tidak mungkin dapat mengetahui letak elektron dengan tepat pada waktu yang bersamaan.
- Elektron dalam atom mengelilingi inti atom pada tingkat energi/kulit atom tertentu.










Lengkap dan mudah untuk dipahami.. makasi min
BalasHapus